Il New England Journal of Medicine ha pubblicato i risultati del RCT condotto da Moderna sugli adolescenti tra 12 e 17 anni di età.(1,2) Affrontando l’analisi del RCT, va premesso che la credibilità dei risultati favorevoli (alla tecnologia sanitaria in sperimentazione) è bassa, per la compresenza di almeno tre delle quattro maggiori condizioni che declassano la credibilità di una ricerca:(3)
- sponsor commerciale,(4) oltretutto monosponsor, il che è risultato costituire un’aggravante dell’aggravante;(5)
- relazioni finanziarie dei ricercatori principali,(6) in realtà il primo Autore non dichiara relazioni particolari, ma 10 degli altri 13 dichiarano relazioni importanti/importantissime con Moderna, compresi i due biostatistici, che dovrebbero sempre essere indipendenti;
- interruzione prima del termine pianificato “per benefici”,(7) la distorsione per esagerazione dei benefici è massima quando gli eventi sono meno di 200, ma resta significativa anche quando sono più di 500;
- e dubbi sul mantenimento della quarta condizione,(8) dato che un doppio cieco è molto difficile da mantenere, in considerazione della pesante sproporzione di reazioni avverse tra il vaccino e l’iniezione salina di controllo.
Quanto sopra richiamato, però, si traduce all’opposto in credibilità molto alta quando si riportano risultati sfavorevolial prodotto dello Sponsor(che pure saranno in seguito esaminati), perché è del tutto implausibile che i ricercatori forzino i dati per danneggiare lo Sponsor che li paga e li incentiva, anche con azioni dell’Industria produttrice. In ogni caso, lo Sponsor Moderna dichiara senza reticenze nella 2a pagina del RCT pubblicato sul NEJM (le sottolineature sono mie): “The trial sponsor, Moderna, was responsible for the overall trial design (with input from the Biomedical Advanced Research and Development Authority), site selection and monitoring, and data analysis. Investigators were responsible for data collection. Two medical writers funded by Moderna assisted in drafting the manuscript for submission.”
La Tabella sottostante mostra i risultati principali. Il RCT studia per una durata mediana di 53 giorni dopo la 2a dose (ma per l’efficacy non considera i 13 giorni successivi alla 2a dose, dunque studia l’efficacia per 40 giorni) 2.489 adolescenti di 12-17 anni che hanno ricevuto le due dosi di vaccino vs 1.243 adolescenti che hanno ricevuto una iniezione salina di “placebo”. L’obiettivo primario è stato la sicurezza, uno di quelli secondari l’efficacia teorica (efficacy).
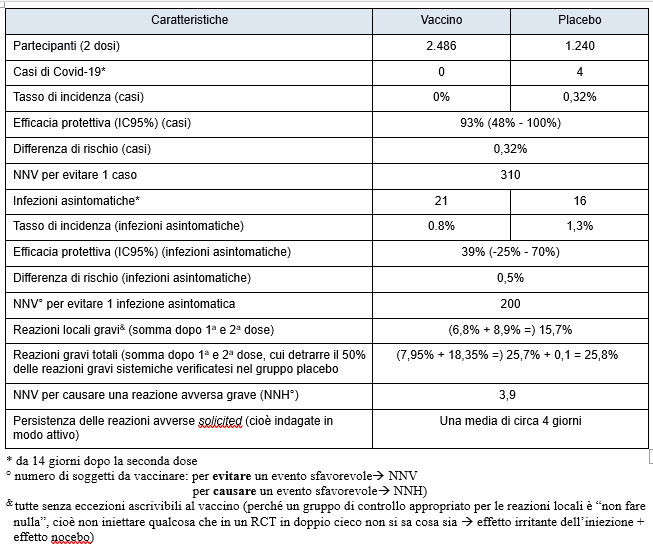
Nelle conclusioni gli autori affermano “acceptable safety profile in adolescents”. Giudichino i lettori quanto corrisponda ai dati l’accettabilità dichiarata. Le reazioni avverse rilevate con sorveglianza attiva nella 1a settimana si avvicinano al 95% per quelle locali e superano l’86% per quelle sistemiche. Qualche definizione internazionale:
- Grade 1 – Mild: symptoms causing no or minimal interference with usual social & functional activities
- Grade 2 – Moderate: symptoms causing greater than minimal interference with usual social & functional activities
- Grade 3 – Severe: symptoms causing inability to perform usual social & functional activities
- Grade 4 – Potentially life-threatening: symptoms causing inability to perform basic self-care functions OR Medical or operative intervention indicated to prevent permanent impairment, persistent disability, or death.
- Serious adverse events (SAEs) – any untoward medical occurrence that:
- resulted in death,
- was life-threatening,
- required inpatient hospitalization or prolongation of existing hospitalization,
- or resulted in persistent disability/incapacity.
NB: in un RCT non è accettabile dire “no vaccine related SAEs”, ma ci si dovrebbe limitare a rilevare le differenze, nel bene e nel male, attribuendole di regola al trattamento sperimentale,(9) salvo ben motivate eccezioni legate a eventi indiscutibilmente accidentali.
A differenza di quanto di regola si sente dire, le reazioni avverse non sono state soprattutto lievi (Grade 1): infatti, quelle moderate (Grade 2) in vari casi, in particolare per le reazioni sistemiche, sono decisamente più di quelle lievi. Le gravi (severe, Grade 3) sono inabilitanti per tutta la loro durata. Notare che il RCT non specifica la suddivisione delle durate per Gradi, si limita a informare che “Solicited local or systemic reactions generally persisted for a mean of approximately 4 days”, ma in una parte dei casi evidentemente di più, perché la tabella S5 dell’Appendice riporta i casi in cui sono persistite oltre i 7 giorni. Va poi respinto ogni tentativo di considerare gli effetti avversi riportati al netto di quanto appare nel gruppo placebo, in particolare per le reazioni locali, che sarebbero zero con un vero placebo, consistente nel non fare nulla.
Ci sono inoltre state, nel gruppo vaccinato, 3 reazioni molto gravi (Grade 4 – Tabella S8, iperpiressia, mal di testa e vomito di grande violenza), che hanno richiesto l’accesso ospedaliero al dipartimento di urgenza/emergenza o in ricovero. Tre sono poche? Non proprio, sono l’1,2 per mille, cioè, proiettate su 3.415.239 ragazzi italiani dai 12 ai 17 anni, significherebbe mandare in ospedale circa 4.100 nostri ragazzi, oltre a quelli che avrebbero/avranno reazioni inabilitanti gravi (severe, di grado 3), che sono molti di più: 6,8% dopo la 1a iniezione, cioè oltre 232 mila, e 8,9% dopo la 2a iniezione, cioè 304 mila. Di questi, quelli con affaticamento grave sarebbero 51.200 dopo la 1a iniezione, e circa 260.000 dopo la 2a. Potrebbe essere utile sottoporli ad accertamenti (troponina di screening, ecografia cardiaca, per arrivare nel caso a una risonanza magnetica) per capire quanti di questi nascondano qualche forma di miocardite o pericardite, come ha mostrato il caso del farmacista di Bari che ha voluto vederci chiaro sull’affaticamento grave del figlio adolescente.(10)
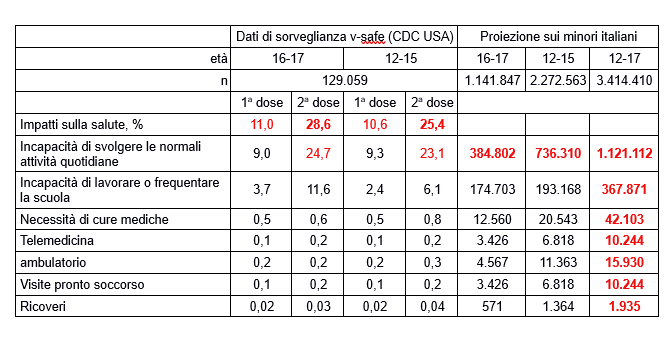
Chi obiettasse che nella realtà non vi sarebbe la percezione di danni così frequenti, dovrebbe ricredersi esaminando i dati di v-safe, il più vasto programma di sorveglianza (quasi) attiva fatto partire dai CDC USA, cui fa riferimento la sottostante Tabella, che mostra le reazioni riferite da adolescenti di età compresa tra 12 e 17 anni (N = 129.059) che hanno completato almeno un’indagine v-safe sullo stato di salute relative ai giorni 0-7 dopo aver ricevuto il vaccino Pfizer BioNTech COVID-19 negli Stati Uniti dal 14-12-2020 al 16-07-2021,(11) con proiezioni delle percentuali di effetti rilevati sulla corrispondente popolazione italiana.
A fronte di questi seri danni, quale sarebbe il beneficio? Nel RCT di Moderna il gruppo placebo ha mostrato 4 (quattro) casi di Covid-19 sintomatica (0,33% dei partecipanti), diciamo pure 8 nel fare un confronto con il gruppo vaccinato, di numerosità doppia, nel quale però si sono manifestate (2.482+2.478=) 4.960 reazioni avverse locali, di cui (170+220=) 390 gravi, tutte da attribuire al vaccino; e (1.701+2.134=) 3.835 reazioni avverse sistemiche, di cui (46+340=) 386 gravi, queste ultime in massima parte da attribuire al vaccino, e 3 molto gravi, da vaccino. Un cattivo affare per questi ragazzi, cui si è anche preclusa un’infezione naturale con conseguenze quasi invariabilmente lievi (v. Aggiornamento nazionale ISS al 14 luglio ’21, pubbl. 16 luglio: da 0 a 19 anni ~50% asintomatici, ~30% paucisintomatici, ~20% casi lievi) e il lascito di un’immunità più robusta e duratura di quella vaccinale, allo stato delle conoscenze,(12,13) con ricadute positive anche sulla “circolazione del virus” nella comunità. (NB: per documentazione di quest’ultima affermazione si può far riferimento alle slide da 53 a 57 dell’incontro del 31/07/2021 del Gruppo di Studio InfoVax Evidence Based, https://www.sostenibilitaesalute.org/documenti-gds/).
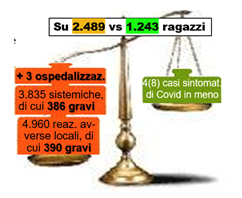
L’immagine di una bilancia può servire per rappresentare graficamente il bilancio tra effetti avversi severi e benefici supposti (che è discutibile siano tali, se valutati nel tempo, dato che con le vaccinazioni si rischia di privare questi ragazzi di una protezione ben più robusta e duratura di quella vaccinale).
Alberto Donzelli
1. Ali K, Berman G, Zhou H et al. Evaluation of mRNA-1273 SARS-CoV-2 Vaccine in Adolescents. New Eng J Med 2021 Aug 11, doi: 10.1056/NEJMoa2109522
2. Supplement to: Ali K, Berman G, Zhou H, et al. Evaluation of mRNA-1273 SARS-CoV-2 vaccine in adolescents. N Engl J Med. DOI: 10.1056/NEJMoa2109522
3. http://www.nograzie.eu/wp-content/uploads/2021/04/Lettera-90.pdf, pag. 5-7
4. https://pubmed.ncbi.nlm.nih.gov/30132025/
5. https://www.bmj.com/content/335/7631/1202
6. https://www.bmj.com/content/bmj/356/bmj.i6770.full.pdf
7. https://pubmed.ncbi.nlm.nih.gov/20332404/
8. https://pubmed.ncbi.nlm.nih.gov/22945832/
9. https://autismoevaccini.files.wordpress.com/2015/12/rapporto_istisan_menb_jun_2015.pdf, p. 2.2.2 Sicurezza, pagina 24
11. https://covid.cdc.gov/covid-data-tracker/#datatracker-home