Da mesi varie Agenzie e Autorità sanitarie di paesi occidentali rilasciano dichiarazioni su una possibile o raccomandabile introduzione di richiami annuali per la vaccinazione antiCOVID-19, “così come accade per i vaccini antinfluenzali”, lasciando intendere che la prassi riguarderebbe tutta la popolazione. Si è anche già parlato di richiamo a due dosi per i giovanissimi, come pure – in tal caso routinario – per anziani e fragili, che potrebbero non generare risposte immunitarie sufficienti. Le istituzioni statunitensi si sono spinte a ipotizzare l’inserimento della vaccinazione anti-COVID-19 tra quelle pediatriche di routine.
In tal modo, oltre a “normalizzare” i richiami routinari anti-COVID, si vorrebbe dare una spinta decisiva anche alla vaccinazione influenzale, che nel nuovo Piano Nazionale Vaccini si raccomanda dai 6 mesi ai 5 anni, e poi dai 60 anni a fine vita, con obiettivi a lungo termine di copertura vaccinale ≥75% per gli “anziani”.
In realtà i tentativi di raggiungere coperture vaccinali altrettanto elevate, riproposti tutti gli anni dal Ministero della Salute italiano, sono regolarmente frustrati, dato che nella stagione 2021-22 solo un italiano su 5 (20,5%, dati ISS) ha effettuato l’antinfluenzale, benché la percentuale salga al 65,3% tra i soggetti ≥65 anni.
In realtà il Gruppo NoGrazie aveva già preso posizione contro una vaccinazione antinfluenzale indiscriminata [1], mostrando i risultati negativi (salvo che per cardiopatici in fase attiva) delle ricerche più valide, come metanalisi di studi clinici randomizzati controllati/RCT [2, 2’], oltre a un gigantesco studio osservazionale con disegno di regressione discontinua [3], che simula un RCT ad aderenza imperfetta e supera i bias che affliggono la maggior parte degli altri studi osservazionali sul tema. Lo studio [3], nel Regno Unito, aveva considerato i ricoveri ospedalieri da Aprile 2000 a Marzo 2011 (170 milioni) e i decessi fra gennaio 2000 e dicembre 2014 (7,6 milioni), calcolando i tassi, aggiustati per età, per ogni 10.000 persone, e confrontando i tassi di ricovero e mortalità dei 55–75enni. Il riscontro nei vaccinati era stato di una tendenza sfavorevole nell’insieme della popolazione in esame sia per ricoveri che per mortalità per ciascuno degli esiti considerati:
+0,6 (da -1,5 a +2,7) ricoveri per polmonite e influenza ogni 10.000 anziani,
+2,3 (da -2,8 a +7,4) ricoveri per malattie respiratorie ” ” “
+5,1 (da -2,7 a +12,8) ricoveri per malattie circolatorie ” ” “
+9,1 (da -1,4 a +19,6) ricoveri totali ” ” “
+1,1 (da -1,0 a +3,3) morti totali ” ” “.
Nel 2022 è stato pubblicato l’aggiornamento della metanalisi dei RCT sugli effetti cardiovascolari/CV dell’antinfluenzale negli anziani [4], confermando di fatto che è vantaggiosa solo nell’anno che segue a una sindrome coronarica acuta, ma non nei confronti di anziani stabili, senza vantaggi quanto a eventi CV e persino con tendenza all’aumento della mortalità CV, come mostrano le slide qui riprodotte:
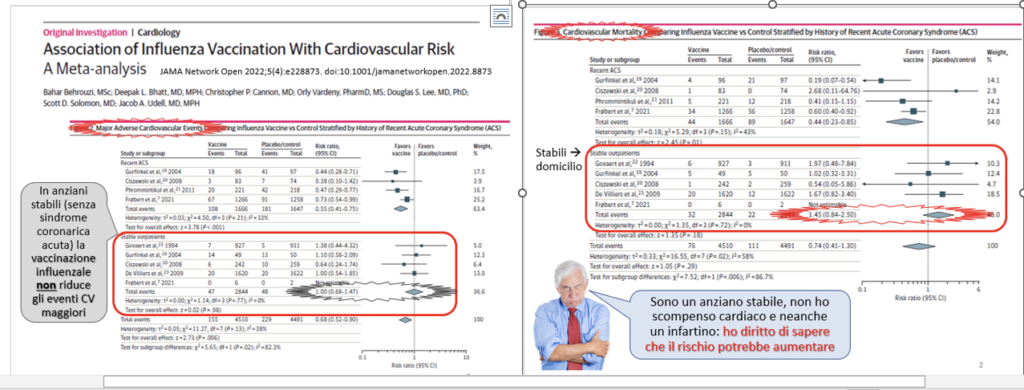
Ora si è aggiunto anche uno studio di coorte di 20 anni su 13,44 milioni di anziani del Regno Unito [5], in cui gli autori si proponevano di dimostrare la protezione da demenza delle vaccinazioni. Lo studio invece ha mostrato un inatteso significativo aumento del rischio di demenza (RR 1,38; 1,36-1,40), che però non era influenzato dalle vaccinazioni infantili, ma quasi solo dall’antinfluenzale (RR 1,39; 1,37-1,41), e in subordine dall’antipneumococcica (RR 1,12; 1,11-1,13). Benché lo studio abbia adottato numerose correzioni e misure per evitare i bias che avevano afflitto precedenti studi osservazionali (compresa l’applicazione di un lag period di 10 anni) e analisi di sensibilità, i risultati sono rimasti statisticamente significativi e clinicamente rilevanti. A dispetto di ciò, gli autori ipotizzano fattori di confondimento non individuati “per l’assenza di ogni razionale biologico per spiegare quell’associazione”. Con ciò, mostravano di ignorare le ricerche che avevano documentato effetti infiammatori successivi alla vaccinazione influenzale in adulti-anziani [6] e in gravide [7-10], e la documentazione di un effetto dose per chi aveva effettuato ≥13 vaccinazioni, con OR di demenza 1,55 [5].
Dunque non si dovrebbe lasciar accreditare (e con quale insistenza!) la “normalità” di una rivaccinazione annuale, che sarebbe “già in atto per l’influenza”. Ciò vale a maggior ragione per le vaccinazioni anti-COVID-19, e ciò:
- non solo perché il loro abbinamento nello stesso giorno con l’antinfluenzale ha già sollevato segnali allarmanti di aumento di ictus per il vaccino Pfizer [11], per altro già emersi chiaramente in un confronto con il vaccino Moderna in 434.000 veterani USA [12], con un inatteso quanto scotomizzato eccesso di 10,9 eventi di ictus ischemico per 10.000 vaccinati nel confronto con i vaccinati Moderna, oltre a 14,8 eventi di infarto miocardico e 11,3 altri eventi tromboembolici per 10.000
- e non solo per l’entità delle reazioni avverse, degli effetti avversi già documentati e degli effetti a medio termine sulla mortalità totale [*], che ne renderebbero improponibile la continua ripetizione; per non parlare degli oneri organizzativi e finanziari (in termini di costo-opportunità)
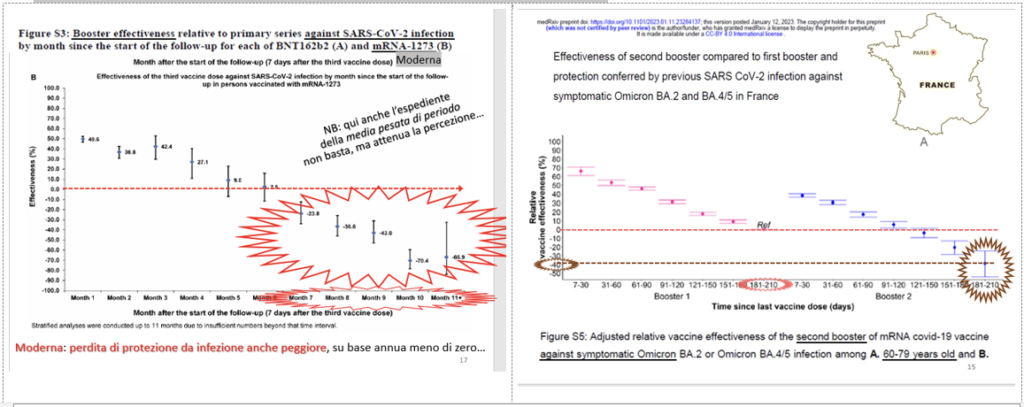
- ma anche per l’ormai chiara rapida perdita di efficacia pratica (VE) protettiva verso l’infezione, fino all’azzeramento e alla negativizzazione dell’effetto, come mostrano i dati del Qatar [13], che ha documentato il più lungo follow-up ad oggi degli effetti del booster. Nonché lo studio francese [14] in cui a 6 mesi dalla 3a dose la VE verso l’infezione è già a zero, ma a 6 mesi dalla 4a dose è già del 40% sotto al livello dei non vaccinati.
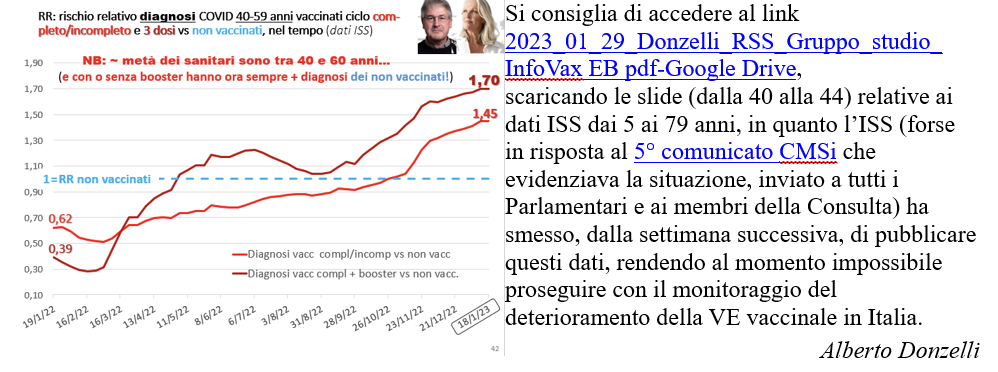
La stessa situazione si sta verificando in Italia, come documentano i dati ISS, monitorati dalla Commissione Medico-Scientifica indipendente/CMSi fino alla settimana del 18-1-2023, di cui si riproduce la situazione dei 60-79enni.
1. Donzelli A, Agostini D, Bellavite P, Cattaneo A, Duca P, Serravalle E. (2020). Vaccinazione antinfluenzale: che cosa dicono le prove scientifiche. Giovanni Fioriti Editore, Roma.
2. Udell JA, Zawi R, Bhatt DL, Keshtkar-Jahromi M, Gaughran F, Phrommintikul A, et al. (2013a). Association between influenza vaccination and cardiovascular outcomes in high-risk patients: a metaanalysis. JAMA 310, 1711-20.
2’. Stessi autori, Supplementary Online Content.
3. Anderson ML, Dobkin C, Gorry D. (2020). The effect of influenza vaccination for the elderly on hospitalization and mortality. Ann Intern Med 172, 445-52.
4. Behrouzi B, Bhatt DL, Cannon CP, et al. Association of Influenza Vaccination With Cardiovascular Risk: A Meta-analysis. JAMA Netw Open. 2022 Apr 1;5(4):e228873. doi: 10.1001/jamanetworkopen.2022.8873.
5. Douros A, Ante Z, Suissa S, Brassard P. Common Vaccines and the Risk of Incident Dementia: A Population-based Cohort Study. The Journal of Infectious Diseases, 2022;jiac484. https://doi.org/10.1093/infdis/jiac484
6. Donzelli A. Letter http://www.cmaj.ca/content/190/1/E3/tab-e-letters to: Casado I, Dominguez A, Toledo D, et al. CMAJ 2018 January 8;190:E3-12. doi: 10.1503/cmaj.170910
7. Christian LM, Iams JD, Porter K, Glaser R. Inflammatory responses to trivalent influenza virus vaccine among pregnant women. Vaccine 2011, 29, 8982–8987. [CrossRef] [PubMed]
8. Christian LM, Porter K, Karlsson E, et al. Serum Proinflammatory Cytokine Responses to Influenza Virus Vaccine among Women during Pregnancy versus Non-Pregnancy. Am. J. Reprod. Immunol. 2013, 70, 45–53. [CrossRef] [PubMed]
9. Christian LM, Porter K, Karlsson E, et al. Proinflammatory cytokine responses correspond with subjective side effects after influenza virus vaccination. Vaccine 2015, 33, 3360–3366. [CrossRef] [PubMed]
10. Donzelli A. Influenza Vaccination of Pregnant Women and Serious Adverse Events in the Offspring. Int J Environ Res Public Health. 2019 Nov 7;16(22).
11. https://www.dailymail.co.uk/health/article-11681217/Getting-Pfizers-Covid-booster-flu-shot-day-raise-risk-STROKE.html
12. Dickerman BA, Madenci AL, Gerlovin H, et al. Comparative Safety of BNT162b2 and mRNA-1273 Vaccines in a Nationwide Cohort of US Veterans. JAMA Intern Med. 2022;182(7):739-746. doi:10.1001/jamainternmed.2022.2109.
13. Chemaitelly H, Ayoub HH, Tang P, et al. Long-term COVID-19 booster effectiveness by infection history and clinical vulnerability and immune imprinting. Preprint Long-term COVID-19 booster effectiveness by infection history and clinical vulnerability and immune imprinting (medrxiv.org)
14. Tamandjou C, Auvigne V, Schaeffer J, et al. Effectiveness of second booster compared to first booster and protection conferred by previous SARS CoV-2 infection against symptomatic Omicron BA.2 and BA.4/5 in France. Preprint https://doi.org/10.1101/2023.01.11.23284137.
15. ISS. 28/1/2023 – Report COVID-19, le novità https://www.epicentro.iss.it/coronavirus/aggiornamenti
[*] Anche tali effetti sono oltremodo allarmanti, come documentano i dati dell’Ufficio Nazionale per le Statistiche (ONS) dell’UK, che mostravano anche i tassi di mortalità per stato vaccinale, la cui pubblicazione è stata però inspiegabilmente interrotta dopo maggio 2022. E gli stessi dati dello studio su mortalità ed effetti avversi per stato vaccinale nella provincia di Pescara, presentati come prova della minor mortalità dei vaccinati, che invece – se rianalizzati correggendo gli incredibili errori da cui lo studio è affetto – mostrano esattamente l’opposto, come documenterò in una prossima Lettera e con l’invio di un articolo a Vaccines.